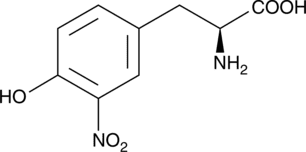
Nitrotyrosin, korrekter 3-Nitrotyrosin, ist eine nicht-proteinogene Aminosäure. Die Verbindung entsteht in Organismen durch Einwirkung der Reaktiven Stickstoffspezies Peroxinitrit auf Tyrosin.
Eigenschaften
3-Nitrotyrosin ist ein Derivat der proteinogenen Aminosäure Tyrosin. Es ist ein gelblich bis leicht grünlicher Feststoff mit einem Zersetzungspunkt bei etwa 235 °C.
Vorkommen und Entstehung
Von den beiden möglichen Enantiomeren des chiralen 3-Nitrotyrosins kommt in Organismen nur die L-Form vor. Dort wird es aus der proteinogenen Aminosäure Tyrosin unter Einwirkung des Peroxinitrit-Anions gebildet (nukleophile aromatische Substitution).
Biomarker
3-Nitro-L-Tyrosin dient in der Labordiagnostik als Biomarker für nitrosativen Stress. In einer Reihe von Erkrankungen wie Magenkrebs, Arteriosklerose, Lungenerkrankungen (wie beispielsweise Asthma), Sepsis, Vaskulitis und anderer Entzündungserkrankungen ist der Spiegel von 3-Nitro-L-Tyrosin im Blutserum erhöht. Allgemein ist die Verbindung ein Biomarker für Apoptose (programmierter Zelltod).
Der Nachweis von 3-Nitro-L-Tyrosin kann beispielsweise über HPLC-MS erfolgen.
Literatur
- P. Pacher, I. G. Obrosova, J. G. Mabley, C. Szabo: „Role of nitrosative stress and peroxynitrite in the pathogenesis of diabetic complications. Emerging new therapeutical strategies“, in: Curr Med Chem, 2005, 12, S. 267–275; PMID 15723618; PMC 2225483 (freier Volltext).
- R. Buddi, B. Lin, S. R. Atilano, N. C. Zorapapel, M. C. Kenney, D. J. Brown: „Evidence of oxidative stress in human corneal diseases“, in: J. Histochem. Cytochem., 2002, 50, S. 341–351; PMID 11850437
- K. A. Hanafy, J. S. Krumenacker, F. Murad: „NO, nitrotyrosine, and cyclic GMP in signal transduction“, in: Med Sci Monit, 2001, 7, S. 801–819; PMID 11433215.
- H. Nakazawa, N. Fukuyama, S. Takizawa, C. Tsuji, M. Yoshitake, H. Ishida: „Nitrotyrosine formation and its role in various pathological conditions“, in: Free Radic. Res., 2000, 33, S. 771–784; PMID 11237099.
- A. Ceriello: „Nitrotyrosine: new findings as a marker of postprandial oxidative stress“, in: Int. J. Clin. Pract. Suppl., 2002, 129, S. 51–58; PMID 12166608.
- M. W. Duncan: „A review of approaches to the analysis of 3-nitrotyrosine“, in: Amino Acids, 2003, 25, S. 351–361; PMID 14661096.
- D. Tsikas, K. Caidahl: „Recent methodological advances in the mass spectrometric analysis of free and protein-associated 3-nitrotyrosine in human plasma“, in: J. Chromatogr. B, Analyt. Technol. Biomed. Life Sci., 2005, 814, S. 1–9; PMID 15607702.
Einzelnachweise